Exercício-01
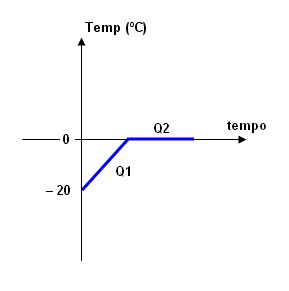
O diagrama representa a quantidade de calor absorvida por
dois corpos A e B de massas iguais em função da temperatura. A relação entre os calores específicos dos
corpos A e B é:
a) 2/3 b)
3/4 c) 4/9 d) 9/4
Solução:
Resp. Alternativa: d
Exercício-02
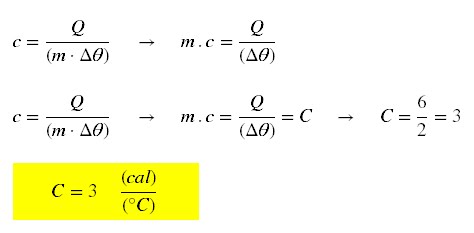
No exercício anterior, a capacidade térmica do corpo A vale:
a) 6 cal/ºC b)
3 cal/ºC c) 2 cal/ºC d) 4/3 cal/ºC
Solução:
Resp. Alternativa: b
Exercício-03
Ainda considerando o exercício-01, se a massa do corpo B é 12 gramas , o calor
específico da substância que o constitui vale:
a) 0,5 cal/g.ºC
b) 16 cal/g.ºC c) 1/9
cal/g.ºC d) 4/3 cal/g.ºC
Solução:
Resp. Alternativa: c
Exercício-04
Sabe-se que o calor latente de fusão do gelo é 80 cal/g, o
calor específico do gelo é 0,5 cal/g.ºC e o calor específico da água é 1
cal/g.ºC. A quantidade de calor
necessária para fundir um bloco de gelo de massa 500 g inicialmente à
temperatura de – 20ºC é:
a) 40000 cal b)
45000 cal c) 35000 cal d) 5000 cal e) n.d.a
Solução:
m = 500 g
Δθ = 20 ºC
c = 0,5
cal/g.ºC
L = 80
cal/g
Q1 = m.c. Δθ = 500*0,5*20 = 5000 cal
Q2 = m*L=
500*80 = 40000 cal
Portanto, calor necessário para fundir todo o gelo é:
Q = Q1 + Q2 = 5000 + 40000 = 45000 → Q = 45 000
cal
Resp. Alternativa: b
Exercício-05
São dados calor específico do gelo igual a 0,5
cal/g.ºC; calor específico da água igual
a 1 cal/g.ºC; calor latente de fusão do gelo igual a 80 cal/g. A quantidade de calor necessária para aquecer
90 gramas
de gelo de –10 ºC a + 10 ºC é de:
a) 9000 cal b)
7500 cal c) 5550 cal d) 12 450 cal e) 8550 cal
Solução:
A quantidade total de calor necessária é:
Q = Q1 + Q2 + Q3
Q1 = m*c*(θf
– θi) = 90*0,5*(0 – (‒10)) = 450 cal
Q2 = m*L = 90*80 = 7200 cal
Q3 = m*c*(θf
– θi) = 90*1*(10 – 0) = 900 cal
Portanto, Q = 450 + 7200 + 900 = 8550 →
Q = 8550 cal
Resp. Alternativa: e
Exercício-06
Queremos determinar o calor latente de vaporização da água.
Para tal, dispomos de uma massa de água a 20ºC e de uma fonte de calor de
potência constante. Verificou-se que a massa de água em contato com a fonte de
calor atinge o ponto de ebulição depois de 20 segundos. Continuando em contato com essa fonte, toda
massa foi vaporizada, após o início da ebulição, em 130 segundos. Qual o calor latente de vaporização da água?
a) 32,5 cal/g b)
325 cal/g c) 52 cal/g d) 520 cal/g e) n.d.a
Solução:
Q = m*c*Δt =
m*1*(100 – 20) = 80*m → Q = 80*m
Houve vaporização total em 130 s.
Fonte de calor de potência constante, portanto;
Q absorvida em 20 s →
80*m ------ 20 s
Q’ ← ----- 130 s
Q’ = 520*m
Q’ = m*L
m*L = 520*m →
L = 520 cal/g
Resp.Alternativa: d
Exercício-07
Uma esfera de chumbo de massa igual a 2 Kg é aquecida até 100ºC e,
em seguida, colocada num calorímetro contendo 2 Kg de água a 25ºC. Após atingido o equilíbrio térmico,
observou-se um aumento de 25/3 ºC na temperatura da água. Qual o calor específico do chumbo? Dado calor específico da água = 1 cal/g.ºC.
a) 1 cal/g.ºC b)
1/8 cal/g.ºC c) 1/4 cal/g.ºC d)
1/6 cal/g.ºC e) n.d.a.
Solução:
Água:
Δt = t i – t f
= t f – 25 ↔ 25/3 = t f – 25 ↔ t f = 25 + 25/3 =
100/3 ↔ t f = 100/3
Chumbo:
Δt = t i – t f
= 100 – 100/3 = - 200/3
Q(água) + Q(chumbo) = 2000*1*25/3 + 2000*c*(-200/3) = 0
2000*c*(200/3) = 2000*1*25/3
→ c = 1/8 = 0,125 cal/g.ºC
Resp. Alternativa: b
Exercício-08
Massas iguais de água quente e gelo fundente são colocadas
num recipiente de capacidade térmica desprezível, resultando no equilíbrio
térmico apenas água a 0ºC. Sendo 80
cal/g o calor latente de fusão do gelo, a temperatura da água quente colocada
será:
a) 80 ºC
b) proporcional à massa de gelo e água
c) 0ºC, porque 0ºC em relação ao gelo e água é quente
d) indeterminada, face aos dados
e) n.d.a.
Solução:
Exercício-09
Em um calorímetro são colocados 10 g de gelo, fundente à
pressão normal e 10 g
de água à temperatura t. Sabendo-se que todo o gelo se funde, que o calor
latente de fusão do mesmo à pressão normal é 80 cal/g e que o calor específico
da água é 1,0 Kcal/Kg.ºC, certamente:
a) t ≤
100ºC b) t
< 100ºC c) t ≥
80ºC d) t
< 80ºC e) faltam dados
Solução:
Q1 + Q2 = 0
10*80 + 10*1*(0 – t i) = 0 → 800 = 10* t i → t i = 80 ºC
Portanto, t i ≥ 80 ºC
Resp. Alternativa: c
Exercício-10
Num calorímetro de capacidade calorífica desprezível,
colocam-se 150 g
de gelo a 0 ºC com 300 g
de água a 50 ºC. Sabendo-se que o calor
latente de fusão do gelo é 80 cal/g e que calor específico da água é 1
cal/g.ºC; qual é a temperatura final da mistura, após o equilíbrio térmico?
Solução:
Colocando em gráfico e tabela os dados do enunciado, tem-se:
Σ(Q) = 0
(mistura em equilíbrio térmico)
Q1 = m.L =
150*80 = 12 000 cal
Q2 = m.c.Δt = 150*1*t f = (150*t f) cal
Q3 = m.c.Δt = 300*1*( t f – 50) =
(300*t f – 15 000) cal
Q1 + Q2 +
Q3 = 0
12 000 +
(150*t f) +(300*t f – 15 000) = 0 → 450*t f = 3000
t f = 6,7 ºC
Portanto, a suposição inicial está correta.









Nenhum comentário:
Postar um comentário