Gabarito e Comentários no final
Exercício-01 (ITA)
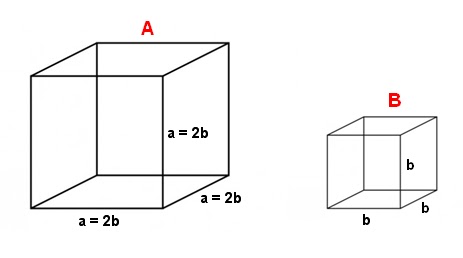
São dados dois cubos A e B de mesmo material e inicialmente
à mesma temperatura T1. O cubo A tem
aresta a e o cubo B, aresta b, tal que a = 2b. Se ambos os cubos
são trazidos à temperatura T2<T1, então, se o cubo B cede ao ambiente uma
quantidade de calor Q, o cubo A cederá:
a) 2Q b)
4Q c) 8Q d) Q e) n.d.a
Exercício-02 (UF-Fluminense)
Três recipientes cilíndricos (1, 2, 3) de massas iguais
contendo substâncias líquidas são aquecidos por fontes de calor de mesma
potência térmica. Comparando-se
simultaneamente nos três recipientes obtém-se o diagrama anexo; cuja
interpretação nos permite afirmar:
a) Se
o líquido dos três recipientes for o mesmo, o recipiente 3 contém a maior massa
líquida;
b) Se
os três recipientes contiverem massas iguais de líquidos diferentes a reta 1
corresponderá ao líquido de maior calor específico;
c) Para
um mesmo líquido contido nos três recipientes, as retas deveriam se superpor
independendo da massa;
d) A
reta 3 é, por certo, relativa ao conjunto (recipiente mais líquido) de maior
capacidade térmica;
e) n.d.a.
Exercício-03 (Mack)
Uma amostra de 5
g de um líquido absorve 50 cal por minuto, aquecendo-se
desde a temperatura de 15ºC até a temperatura de 308 K, em três minutos. Nessas condições, o calor específico do
líquido é:
a) 0,1 cal/g.ºC b)
0,1 cal/g.K c) 1,5 cal/g.K d) 7,5 cal/g.K e) 30,0 cal/g.K
Exercício-04 (FESP)
Um corpo recebe calor de uma fonte na razão de 400 cal/min.
Sua temperatura sofre uma elevação de 200 ºC em 10 minutos. A capacidade do corpo é:
a) 400 cal/ºC
b) 200 cal/ºC c) 40
cal/ºC d) 20 cal/ºC e) n.d.a.
Exercício-05 (UE-Londrina)
Um aquecedor elétrico eleva de 10 ºC a temperatura de 1.000 g de água em 10
minutos. Se utilizarmos esse aquecedor durante 10 minutos para aquecermos 1.000 g de óleo, qual será
a elevação da temperatura do óleo? (calor específico da água: 1,0 cal/g.ºC;
calor específico do óleo: 0,5 cal/g.ºC).
a) 10ºC b) 20ºC c) 40ºC d) 50ºC e) 100ºC
Exercício-06
a) 250
cal/min b) 340 cal/min
c) 270 cal/min d) n.d.a.
Exercício-07 (FM – Santos)
O gráfico da figura representa a quantidade de calor
recebida por um corpo em função da temperatura.
Este gráfico, também, faz parte das questões 8 e 9.
A capacidade térmica do corpo em cal/ºC é:
a) 40 b) 480 c) 24 d) 6.000
e) um valor diferente desses
Exercício-08 (FM – Santos)
Se o calor específico for 0,2 cal/gºC, a massa do corpo é
de: (utilizar o gráfico da questão 7 e eventualmente, utilizar o resultado da
mesma questão.
a) 125 b)
1.000 c) 200 d) 2.000 e) um valor diferente desses
Exercício-09 (FM – Santos)
Se o corpo atingiu o ponto B em 12 minutos, a fonte fornece
calor, em cal/min, à razão de:
a) 40 b) 12
c) 480 d) 1.000 e) um valor diferente desses
Exercício-10
Um corpo absorve calor de uma fonte à razão de 1.000
cal/min. O gráfico da temperatura do
corpo em função do tempo está indicado abaixo.
A capacidade calorífica (ou capacidade térmica) do corpo em cal/ºC será:
a) 4,18x107 b)
200 c) 427 d) 500 e) n.d.a.
Gabarito e Comentários
Justificativa:
Cubo B cede ao
ambiente uma quantidade de calor Q.
Cubo A
Justificativa:
A alternativa a
está incorreta porque se os líquidos são iguais e fontes de calor têm a mesma
potência, o líquido com maior massa esquenta menos então seria recipiente 1 e o
recipiente 3 é o que contém menor massa.
É só analisar a fórmula abaixo.
A alternativa b
está correta, pois, os recipientes contêm massas iguais e fontes de calor têm a
mesma potência, portanto, o líquido com menor calor específico esquenta mais, logo
o a reta-1 corresponde ao líquido de maior calor específico.
A alternativa c é
incorreta, porque líquidos iguais, porém, massas diferentes, resultam em retas
não coincidentes.
A alternativa d é
incorreta, porque quanto maior a capacidade térmica, menor será a temperatura,
portanto, a reta-3 corresponde ao menor capacidade térmica.
Justificativa:
m = 5 g
Ti = 15 ºC = 288 K
Tf = 308 K
50 cal ------- 1 min
Q ------------- 3 min
Q = 150 cal
Portanto,
Q = m.c.(Tf-Ti) →
150 = 5*c*(308 – 288) → c = 1,5 cal/g.K
Justificativa:
400 cal ------------ 1 min
Q -----------------
10 min
Q = 4000 cal
Δθ = 200 ºC
Q = m*c*Δθ =
C*Δθ → C = Q/Δθ =
4000/200 = 20 → Q = 20 cal/ºC
Justificativa:
Quantidade de calor para aquecer água de 10 ºC em 10 min foi
de:
mágua = 1000 g
cágua = 1 cal/gºC
Qágua = mágua.c.Δθa = 1000*1*10
= 10000 cal
Calculando a elevação da temperatura do óleo, utilizando a
mesma quantidade de calor.
móleo = 1000 g
cóleo = 0,5 cal/gºC
Q = 10000 cal
10000 = 1000*0,5*Δθo →
Δθo = 20 ºC
Justificativa:
m = 100 g
Δt = 10 min
c = 0,3
cal/g.ºC
Δθ = 90 ºC
Q = m.c.Δθ = 100.0,3.90 = 2700 cal
2700 cal
--------- 10 min
X ------------------ 1 min
Exercício-7) Alternativa: a
Justificativa:
De gráfico:
ΔQ = 500 –
20 = 480 cal
Δθ = 12 ºC
ΔQ = m.c.Δθ ↔ ΔQ = C.Δθ ↔ 480 = C.12 ↔ C = 40 cal/ºC
Exercício-8) Alternativa: c
Justificativa:
c = 0,2 cal/g.ºC
m = ?
Q = 480 cal
Δθ = 12 ºC
Q = m.c. Δθ ↔ 480 = m.0,2.12 ↔ m = 200
g
Justificativa:
Q = 480 cal
-------- 12 min
x -----------------------
1 min
x = 480/12 = 40 cal
Portanto, a fonte fornece calor a uma taxa de 40 cal/min.
Justificativa:
Δt = 50 – 30
= 20 ºC
Q = 1000 cal (em 1
min)
1000 cal ------- 1 min
x ----------------- 10 min
x = 10000 cal
Q = m.c. Δt
= C. Δt → C = Q/ Δt =
10000/20 → C = 500 cal/ºC







Nenhum comentário:
Postar um comentário