LISTA 2: calorimetria / equilíbrio térmico - ETEc GV (Automação 3º Ano, 2017)
Exercício-01
Tem-se 0,10
Kg de vapor de água a 120 ºC, a pressão atmosférica
normal constante, que deve ser transformado em gelo a – 10 ºC.
a) Determine
a quantidade de calor necessária para transformar esse vapor em gelo a – 10 ºC.
b) Construa
o gráfico de Temperatura x Quantidade de Calor Cedido nessa transformação.
Solução:
Fazendo um croqui do processo para melhorar a visualização.
As quantidades de calor que vamos calcular são calores
cedidos (=perdidos).
Portanto, a quantidade de calor total cedido no processo é Q
= 311,1 KJ.
O gráfico de Temperatura x Quantidade de Calor Cedido. Colocando os valores de temperatura no eixo
das abscissas, tem-se:
Exercício-02
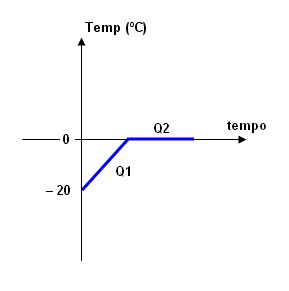
Uma pedra de gelo de 100 g a – 20 ºC é colocada num recipiente com 300 g de água a 60 ºC. Admitindo-se que o sistema esteja à pressão
atmosférica normal e desprezando o calor cedido pelo recipiente, determine a
temperatura de equilíbrio térmico.
Solução:
Supondo que todo o gelo derreteu e a temperatura de
equilíbrio seja superior a 273 K (0 ºC).
Vejamos a figura:
Em equilíbrio térmico:
Q1 + Q2 + Q3 + Q4
= 0
0,3*4,2x10³*(θe ‒ 333) + 0,1*4,2x10³*( θe ‒ 273) + 0,1*3,3x105
+ 0,1*2,1x10³ *(273 – 253) = 0
1260.(θe ‒ 333) + 420.(θe ‒ 273) + 33000 + 4200 = 0
1680.θe ‒ 534240 + 37200 = 0
→ 1680.θe = 497040 → θe = 295,857 K → θe = 22,86 ºC
A suposição inicial está correta.
Outra maneira de resolver:
Supondo que nem todo gelo derreteu.
Gelo:
Q = m*c*Δθ
= 100*0,5*20 = 1000
Q = m.L = 100*80 = 8000
ΣQ = 1000 + 8000 = 9000 cal (Qg)
Água: (60º → 0ºC)
Q = m*c*Δθ
= 300*1*60 = 18 000 cal (Qa)
Qa > Qg ↔ 18000 cal > 9000 cal
Portanto, derrete todo o gelo, logo sobram 18 000 – 9 000 =
9 000 cal
Água derretido + água
Q = m*c*Δθ → 9000 = (300 + 100)*1* Δθ → Δθ = 22,5ºC
Portanto,
a temperatura final do sistema é: 22,5ºC
Logo,
o gráfico correto é:
Exercício-03
Para se determinar o calor específico de que é feito um
corpo de massa 500 g ,
inicialmente a 70 ºC ele é colocado junto com 400 g de água a 20 ºC. O
equilíbrio se estabelece aos 30 ºC. Nestas condições calcule o calor específico
de que é feito o corpo em cal/g.ºC. (dado 1 cal = 4,18 J)
Solução:
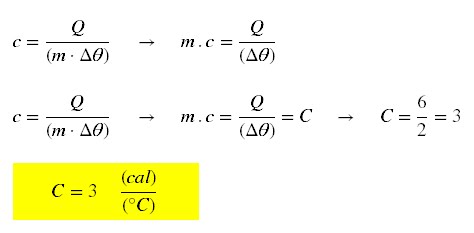
Em equilíbrio térmico: Q1 + Q2 = 0
0,500.c.(303 – 343) + 0,400.4,2.10³.(303 – 293) = 0
-20c + 16800 = 0 →
c = 840 J/Kg.K → c = 840/(1000.4,18.1) = 0,2
Exercício-04 (FATEC – SP)
Uma xícara com 200
g de água quente é esfriada tendo a temperatura
diminuída de 20 ºC. Considere o calor
específico da água igual a 1,0 cal/g.ºC e o calor de fusão do gelo igual a 80
cal/g. A quantidade de calor perdida por
essa água é suficiente para fundir quantas gramas de gelo fundente?
Solução:
xícara: m = 200
g , Δθ =
20 ºC (= diferença de temperatura), 1,0 cal/g.ºC
No processo de resfriamento a água libera a quantidade de
calor igual a:
Q = m.c. Δθ =
200.1.20 = 4000 cal
Gelo fundente: m =
?, L = 80 cal/g
Essa energia
provoca a fusão de m gramas de gelo fundente:
Q = m.L ↔ 4000 =
m.80 ↔ m = 50 g
Exercício-05
Um fragmento de alumínio de 10 g à temperatura de 80 ºC é
colocada em 10 g
de água à temperatura de 20 ºC. Sendo o
calor específico do alumínio 0,2 cal/g.ºC e o calor específico da água é 1
cal/g.ºC, determine a temperatura de equilíbrio térmico.
Solução:
Alumínio:
m = 10 g ;
θi = 80ºC; c = 0,2 cal/gºC
Água:
m = 10 g ; θi = 20ºC; c = 1
cal/gºC
Desenhando a figura do processo:
No equilíbrio tem-se: QAl + QH20 = 0
mAl*cAl*(θe – 80) + mH2O*cH2O*(θe – 20) = 0
10*0,2*( θe – 80) + 10*1*(θe – 20) = 0
2*( θe
– 80) + 10*(θe – 20)
= 12*θe – 360 = 0 → 12*θe = 360 → θe = 30 ºC
Exercício-06
Numa bacia que contém 18 litros de água à
temperatura de 24 ºC pode-se obter uma mistura à temperatura final de 36
ºC. Desprezando-se a capacidade térmica
da bacia e as perdas para o ambiente, quanto de água a 72 ºC deverá ser
acrescentado na bacia?
Solução:
Fazendo o gráfico de acordo com o enunciado:
Sabemos que : 18 litros = 18 Kg = 18 000 g
Q1+ Q2 = 0
18000.1.(36 – 24) + m.1.(36 – 72) = 0 ↔ 216000 – 36.m = 0 → m = 6000 g
m = 6000 g
= 6 Kg ↔ V= 6
litros
Exercício-07 (FUVEST)
Um ser adulto e saudável consome, em média, uma potência de
120 J/s. Uma “caloria alimentar” (1
kcal) corresponde, aproximadamente, a 4,0x10³ J. Para mantermos saudáveis, quantas “calorias
alimentares” devemos utilizar, por dia, a partir dos alimentos que ingerimos?
Solução:
P = 120 J/s ↔ P = Q/t
Quanta energia
consumirá por dia se um humano consome 120 J em 1 segundo?
1 dia = 24x60x60 = 86400 s.
Por regra de três, temos:
120 J ---------- 1 s
x ----------
86400 s
x = 120 x 86400 = 10368000 J
Convertendo para kcal:
1 kcal ----------- 4,0 x 10³ J
y ------------ 10368000 J
y = 10368000/4000 = 2592 → y = 2592
Kcal
Exercício-08 (Mackenzie)
Uma fonte calorífica fornece calor continuamente, à razão de
150 cal/s, a uma determinada massa de água. Se a temperatura da água aumenta de
20 ºC para 60 ºC em 4 minutos, sendo o calor específico sensível da água 1,0
cal/g.ºC, qual é a massa de água aquecida, em gramas?
Solução:
Fazendo o gráfico de acordo com o enunciado:
Quantidade de calor necessário para aumentar a temperatura
de 20ºC para 60ºC é:
150 cal ------ 1 s
x -------------- 240 s
x = 36 000 cal
Seja m a massa de água, então temos:
Q = m.c.Δθ → 36000
= m.1.(60 – 20) = 40.m → m
= 900 g
Exercício-09 (PUCCAMP)
Uma barra de cobre de massa 200 g é retirada do interior
de um forno, onde estava em equilíbrio térmico, e colocada dentro de um
recipiente de capacidade térmica 46 cal/ºC que contém 200 g de água a 20 ºC. A temperatura final de equilíbrio é de 25
ºC. Calcule a temperatura do forno, em
ºC. Dado: cCU = 0,03
cal/g.ºC
Solução:
Pelo princípio da calorimetria (conservação de energia)
(Q1 – barra de cobre; Q2 – recipiente; Q3 – água)
Q1 + Q2 + Q3 = 0
Fazendo um croqui para visualizar melhor o processo de troca de calor:
Fazendo um croqui para visualizar melhor o processo de troca de calor: